Introduction
Materials and Methods
실험동물 및 실험설계
성장능력 평가
혈액 대사 생리 평가
장관조직 형태 및 구조 분석
사이토카인 분석
장내 미생물 비교 분석
통계 분석
Results and Discussion
면역조절물질 첨가에 따른 자돈 일당증체량, 사료섭취량, 사료효율
면역조절물질 첨가에 따른 자돈 혈액 생화학 및 혈구세포 분석
면역조절물질 첨가에 따른 자돈 장관면역 변화 분석
Conclusion
Introduction
국내 농업생산액 내 축산업이 차지하는 비중은 약 43%이며 전체 농업 생산 품목 중 돼지 생산액은 농업 생산액에서 약 17%로 가장 높은 비율을 차지하고 있다(Lee et al., 2023). 이는, 양돈산업이 국내 농업 및 축산업 부문에서 중추적인 역할을 함을 의미한다. 그러나, 현재 ’22년 국내 양돈 농가의 생산성 지표인 PSY (piglets per sow per year)는 약 21두로 유럽 축산 선진국의 약 66% 수준(덴마크 34.1두, 네덜란드 35두, 프랑스 30.4두)으로 돈육의 선호 증가에도 불구하고 축산 선진국에 비해 상대적으로 낮은 PSY를 나타내고 있다(Lee et al., 2022).
낮은 PSY의 주요 원인으로는 열악한 사육환경과 자돈의 면역력 저하로 인한 외부 병원균의 침입으로 인한 폐사율의 증가가 대표적이다(Muns et al., 2016). 이로 인해, 국내외 양돈 농가에서는 면역체계가 완성되지 않은 자돈의 생존력을 높이기 위해 전통적으로 항생제를 널리 사용해왔다.
항생제는 외부 병원균의 세포벽, 단백질 합성 및 대사 경로를 차단함으로써 돼지 생체 내 병원균의 침입을 막는 역할 동시에 사료 효율 등 생산성을 증가시키는 효과까지 가진다고 알려져 있다(Helm et al., 2019). 하지만, 항생제 사용은 항생세 내성균의 발생과 같은 심각한 보건 사회적 문제 및 가축의 면역체계에도 상당한 부작용을 유발할 가능성이 있다. 그로 인해 유럽연합(EU)는 항생제 사용에 따른 슈퍼박테리아와 같은 항생제 내성균의 등장과 돼지 도체 내 항생제 잔류 문제를 고려하여 ’22년도부터 처방받지 않은 동물용 항생제 사용을 금지하는 법안을 마련하였으며 점진적으로 항생제 사용에 대한 규제를 강화하고 있다(Simjee and Ippolito, 2022).
항생제 사용은 항생제 내성 문제뿐 아니라 현재까지 그 기전은 불분명하나 항생제 노출이 동물의 면역 발달과 정상적인 반응 유지에 부정적인 역할을 한다는 보고가 있다. 또한, 항생제는 장내 유익균에 영향을 미쳐 장내 미생물의 다양성을 감소를 유발하여 장내 미생물 불균형의 원인이 된다고 알려져 있다(Konstantinidis et al., 2020). 이러한 항생제의 다양한 부정적인 영향 떄문에 항생제 대체제 개발 연구가 활발하게 진행되고 있다.
대표적으로 생균제는 세계적으로 가장 활발히 연구되는 면역 증강제의 일종으로 장내 미생물 총 균형 개선과 면역세포 활성에 도움을 주는 것으로 알려져 있다. Lactobacillus plantarum LQ80을 자돈 사료 내 첨가한 연구 결과에 따르면 (i)대조군에 비하여 생균제를 첨가한 그룹에서 혈청 내 면역글로빈 immunoglobulin (Ig)A가 증가하여 점막 면역 강화 효과를 보이며 (ii) interleukin (IL)-8 및 tumor necrosis factor (TNF)-α 수준이 감소함에 따라 불필요한 염증 반응을 억제하는 것을 보고한 바 있다(Mizumachi et al., 2009).
미세조류는 습한 환경에서 주로 발견되는 단세포 또는 다세포의 일종으로 광합성 과정을 통해 이산화탄소를 흡수하고, 산소를 방출하여 지구의 탄소 순환과 기후 조절에 중요한 역할을 수행한다. 또한, 미세조류(예: Chlorella, Scenedesmus 및 Arthrospira)가 포함된 사료 첨가제는 (i) 동물에서 콜레스테롤 저하 효과를 나타내며, (ii)면역 반응을 개선하고, (iii) 젖소의 우유 품질 및 생산 수율을 향상시키며, (iv) 동물 성장 및 육류 및 계란 품질 향상, (v) 항바이러스 및 항균 작용을 통해 질병에 대한 저항력 제공, (vi) 장 기능 개선, (vii) 프로바이오틱스의 군집화 강화, 사료 전환율을 증가시키는 효능이 있다고 보고된 바 있다(Saadaoui et al., 2021).
식품, 의약품, 화장품 등에서 다양한 용도로 사용되고 있는 탱자 껍질 추출물은 (i) IgE 생산 억제 및 알레르기 반응 완화 효과를 보이며 (ii) 항산화 효소 활성 효과를 나타내어 병원균에 대한 항균 효과를 가지고 있다(Park et al., 2011).
자돈의 사료 내 생균제 등 다양한 첨가제 급여에 따른 자돈의 성장, 영양소 이용률 등 생산적인 측면에 관한 연구가 진행되고 있으며, 자돈 사료 내 미세조류, 탱자껍질 추출물첨가에 따른 자돈의 면역적 성상 및 장내 미생물 변화에 관한 연구는 미흡한 실정이다. 따라서, 본 연구는 자돈의 초기 면역을 증진시키기 위해 사료 내 미세조류(Parachlorella spp. 0.5%), 생균제(Lactobacillus paracasei subsp. tolerans 0.1%). 탱자 껍질 추출물 0.2% 첨가에 따른 자돈의 성장능력(일당증체량, 사료효율) 및 혈액대사생리, 면역성상(사이토카인, 장관구조, 미생물 다양성 등) 효과를 평가하고자 동물실험을 수행하였다.
본 연구에서 탱자껍질 추출물 첨가 급여 그룹에서 IL-2 및 IL-10의 유의적 증가와 자돈 장내 미생물 균총 조절을 확인하였으며, 탱자 껍질 추출물이 자돈 강건성 개선을 위한 사료 첨가제로서의 가능성을 제안한다.
Materials and Methods
실험동물 및 실험설계
이유자돈 사료 내 면역조절물질(미세조류, 생균제, 탱자껍질 추출물)첨가 효과에 따른 성장능력 및 혈액 대사생리, 장관면역변화 특성을 구명하기 위해 평균체중이 8.38 ± 1.08 kg인 3원 교잡종(Landrace × Yorkshire × Duroc)의 이유자돈 60두(28일령)를 처리구 당 15두씩 배치한 후 그룹 당 체중 차이가 유사하게 설정하였다. 실험에 사용된 기초 배합사료는 NRC (2012) 기준에 근거하여 급여하였으며, 기초 배합사료는 Table 1과 같다.
각 처리구별 시험사료 급여 기준은 (i) 대조군(기초 배합사료), (ii) T1 (기초사료 + 미세조류; 0.5% Parachlorella spp.) (iii) T2 (기초사료 + 생균제; Lactobacillus paracasei subsp. tolerans 0.1%), (iv) T3 (기초사료 + 농산부산물; 탱자 껍질 추출물 0.2%)으로 설정하였으며 탱자 껍질 추출물은 (주) 단정바이오의 도움을 받아 열수추출 공법을 통해 직접 추출되었다. 시험기간은 4주로 설정하여 처리 별 시험사료와 물은 자유 채식하도록 하였다.
Table 1.
Ingredients and chemical compositions of experimental diets (basal diet).
| Item | Amount (%) |
| Ingredients | |
| Corn | 56.56 |
| Soybean meal (44%) | 36.20 |
| Tallow | 3.44 |
| L-Lys/HCl | 0.40 |
| DL-Met | 0.13 |
| Mono calcium phosphate | 1.15 |
| Limestone | 1.12 |
| Mineral premixy | 0.25 |
| Vitamin premixz | 0.25 |
| NaCl | 0.50 |
| Calculated composition (%) | |
| ME (kcal·kg-1) | 3,350 |
| CP | 21 |
| Lys | 1.48 |
| Met | 0.45 |
| Ca | 0.73 |
| Total P | 0.64 |
성장능력 평가
돼지의 개시체중(initial body weight, IBW)과 종료체중(final body weight, FBW)을 측정하여 일당증체량(average daily gain, ADG), 일당사료섭취량(average daily feed intake, ADFI) 및 사료효율(Gain : Feed)을 계산하였다. 체중은 시험개시(1일)와 시험종료일(28일)에 측정하였다. 일당증체량은 시험기간 28일 동안의 증체량을 1을 나누어 1일 증체량으로 표시하였다. 일당사료섭취량은 사료 총 급여량에서 잔량을 제외하여 총 섭취량을 구하여 사육 두수로 나누어 1두 당 1일 사료섭취량으로 표시하였다. 사료효율은 일당증체량을 일당사료섭취량으로 나누어 계산하였다.
혈액 대사 생리 평가
혈액을 경정맥으로부터 채취하여 혈청 튜브에 보관하였으며 채취한 혈액은 혈청생화학 및 혈구세포분석에 이용하였다.
혈액 생화학 분석을 하기 위해 채취한 혈액으로부터 혈청을 채취하기 위해 15분 동안 원심분리(1,800 × g) 하였으며 분리된 혈청을 새로운 튜브에 옮긴 후 분석을 위해 80℃에 보관하였다. 생화학 분석은 분석기(Catalyst Dx, IDEXX Laboratories, Inc., USA)를 사용하여 분석하였으며 분석 항목은 글루코오스(glucose), 크레아틴(creatine), 혈액요소질소(blood urea nitrogen), 칼슘(calcium), 총 단백(total protein), 알부민(albumin), 글로불린(globulin), 알라닌 아미노전이효소(alanine aminotransferase), 알칼리성 인산가수분해효소(alkaline phosphatase), 감마 글루타밀 전이 효소(gamma-glutamyl transferase), 총 빌리루빈(total bilirubin), 콜레스테롤(cholesterol), 아밀라아제(amylase) 및 리파아제(lipase)이다.
혈액 내에 존재하는 적혈구, 백혈구 등 혈구세포분석은 시험 종료 시점에 채취한 혈액으로 분석을 실시하였다. 혈구 분석 장비(Clinical Analyzer 7020, Mindray Medical International Co., Ltd., China)로 혈구분석 항목은 적혈구(red blood cells), 적혈구용적(hematocrit), 혈색소(hemoglobin), 평균적혈구용적(mean corpuscular volume), 평균적혈구혈색소(mean corpuscular hemoglobin), 평균적혈구혈색소농도(mean corpuscular hemoglobin concentration), 망상적혈구(reticulocyte), 백혈구(white blood cells), 호중구(neutrophils), 림프구(lymphocytes), 단핵구(monocytes), 호산구(eosinophils), 호염구(basophils) 및 혈소판(platelet)이다.
장관조직 형태 및 구조 분석
시험 종료일에 공시동물을 안락사 후 비장과 공장을 채취하였으며, 공장의 융모 길이 및 음와 깊이를 측정하기 위해 샘플 채취 및 내용물 제거 후 10% buffered formalin에 침지시켰다. 장관 구조 분석은 고정된 공장 조직 샘플을 탈수 및 파라핀으로 블록을 제작 후 5 µm 두께로 rotary microtome (Leica RM2245, Leica Microsystems, Japan)을 사용하여 잘라낸 후 유리 슬라이드에 고정시킨 후 슬라이드를 hematoxylin과 eosin염색을 하였다. 염색이 된 슬라이드는 현미경을 이용하여 융모 길이(villus height)와 음와 깊이(crypt depth)를 측정하였다.
사이토카인 분석
혈청 100 mg을 각각 1 mL 1X phosphate-buffered saline (PBS)에 희석(0.1 g·mL-1)하여 균질화시켰다(Digital Ultra-Turrax T25, IKA, Germany). 균질액을 5,000 × g에서 5분 동안 원심분리하였다. 이후, 상층액은 enzyme linked immunosorbent assay (ELISA) 분석 전까지 -20℃에 보관하였다. ELISA 분석 방법은 돼지 혈청 내 TNF-α ELISA kit (PTA00, R&D Systems, Inc., USA)와 IL-10 ELISA kit (P1000, R&D Systems, Inc., USA)와 IL-2 ELISA kit (CSB-E06783p, Cusabio Inc., China)를 사용하였으며, 제조회사의 방법대로 사이토카인 분석을 실시하였다.
장내 미생물 비교 분석
Metagenomic DNA의 분리 및 16s rRNA 유전자 서열 분석 시 채취한 공시동물의 분변에서 원래의 군집 조성을 그대로 반영할 수 있는 DNA를 얻기 위해 분변 채취 후 DNeasy PowerSoil Kit (Qiagen, Germany)를 사용하여 분변 내 bacterial DNA를 추출하였다. 16S metagenomic library 제작 및 Miseq 장비(Illumina, Inc., USA)를 이용한 염기서열 분석을 하며 각 가축 분변 시료에서 추출한 total DNA에서 세균군집 분석을 목적으로 16s RNA 유전자를 증폭하기 위해 V3-V4 region target primer set와 Kraken automated phylogenetic assignment (KAPA)를 이용하여 polymerase chain reaction (PCR)을 수행하였다. 또한 증폭산물은 AMPure beads (Agencourt Bioscience, USA)를 사용하여 증폭산물 이외의 불순물을 제거하였다. 생산된 FAST quality (FASTQ) 파일은 Cutadapt (v3.2)를 사용하여 어댑터 및 프라이머를 제거하였다. 미생물 조성의 비교 분석을 위해 QIIME (v1.9)을 사용하였으며 분변 내 미생물 군집의 미생물 분포(composition), 다양성(diversity)과 종 풍부도(richness), 균등성(evenness)을 조사하여 α-diversity를 분석하였다. β-diversity 분석은 STAMP software (v2.1.3)를 이용하여 principal coordinates analysis (PCA)로 시각화하였다.
Linear discriminant analysis effect size (LEfSe) 분석 시 각 그룹의 유의미한 미생물학적 분류 수준을 나타내는 biomarker를 규명하기 위해 LEfSe 분석을 실시하였다(http://huttenhower.sph.harvard.edu/galaxy). Kruskal-Wallis 합계 순위 테스트는 두 그룹 간의 분변 미생물 군집의 중요한 차이를 확인하기 위해 수행되었으며 히스토그램 수치를 위해 linear discriminant analysis (LDA) 점수 값이 2.0을 넘는 분류군을 선택하였다.
통계 분석
통계 분석은 SAS version 9.4 (SAS, 2009)를 사용하여 수행하였다. 먼저, 처리구 간의 유의적인 차이를 확인하기 위해 generalized linear model (GLM) 절차를 통해 분산분석(analysis of variance, ANOVA)을 실시하였으며, 분석에서 유의한 차이가 발견된 경우에만 사후검정으로 Tukey’s multiple comparison test를 적용하여 각 처리구별 차이를 구체적으로 비교하였다. 각 실험 단위는 공시동물로 설정하였으며, 결과는 평균과 표준오차(standard error of the mean, SEM)로 표기하였다. 유의성 검정은 95% 유의수준에서 이루어졌다.
Results and Discussion
면역조절물질 첨가에 따른 자돈 일당증체량, 사료섭취량, 사료효율
이유자돈 사료에 면역조절물질(미세조류, 생균제, 탱자껍질 추출물) 첨가 효과에 따른 자돈의 성장능력 변화의 결과는 Table 2와 같다. 사료 내 미세조류, 생균제, 탱자껍질 추출물 첨가 급여 시 종료체중. 일당 증체량, 사료섭취량, 사료효율에 대한 유의적 차이는 관찰되지 않았다(p > 0.05).
Table 2.
Effect of dietary immunomodulatory substance on the growth performance in weanling piglets.
| Item | Days | Treatmentz | SEM | p-value | |||
| CON | T1 | T2 | T3 | ||||
| Body weight (kg) | 1 | 8.36 | 8.36 | 8.41 | 8.40 | 0.29 | 0.99 |
| 28 | 17.45 | 17.55 | 17.73 | 18.37 | 0.83 | 0.85 | |
| Daily weight gain (g·d-1) | 1 - 28 | 324.52 | 328.33 | 332.86 | 356.19 | 25.37 | 0.81 |
| Daily feed gain (g·d-1) | 1 - 28 | 686.48 | 674.45 | 659.29 | 706.48 | 13.48 | 0.10 |
| Feed efficiency | 1 - 28 | 0.47 | 0.49 | 0.50 | 0.50 | 0.04 | 0.918 |
Martins 등(2021)은 자돈을 대상으로 사료에 5% Chlorella vulgaris를 첨가 급여 시 일당증체량 등 자돈의 성장능력에 유의적 차이를 나타내지 않음을 보고하였다. 따라서 본 연구 결과는 미세조류, 생균제, 탱자껍질 추출물의 자돈 사료 내 첨가가 자돈의 생산성에 영향을 미치지 않음을 확인하였다.
면역조절물질 첨가에 따른 자돈 혈액 생화학 및 혈구세포 분석
Alanine aminotransferase (ALT)는 아미노산 대사에 중요한 역할을 하는 효소로, 주로 간세포 내에 존재하며 ALT는 L-알라닌과 알파-케토글루타르산을 피루브산과 글루탐산으로 전환하는 반응을 통해 단백질 대사와 에너지 생성에 중추적인 역할을 수행한다(Wolf, 1999). 간세포가 손상되면 ALT가 세포질에서 혈류로 방출되어 혈중 ALT 수치는 간세포 손상의 주요한 지표로 사용되고 있다(McGill, 2016).
자돈 사료 내 미세조류, 생균제, 탱자껍질 추출물 첨가 급여에 따른 기초 대사 생리 기능 평가하기 위하여 혈청 생화학, 혈액세포 분석한 결과는 Table 3과 같다.
Table 3에서 나타난 바와 같이, ALT (alanine aminotransferase) 수치에서 대조군(control, CON)과 미세조류(T1) 처리구 간에 유의한 차이가 있었다. 미세조류(T1) 처리구에서 ALT 수치가 유의미하게 높게 나타났으며(p < 0.05), 미세조류 첨가가 자돈의 간 기능에 영향을 미칠 수 있음을 시사된다. 반면, 탱자껍질 추출물(T3) 처리구는 대조군과 비교했을 때 ALT 수치가 유의미하게 낮은 값을 보였으며, 탱자껍질 추출물이 자돈의 간 건강에 긍정적인 영향을 미칠 수 있음을 보여준다. 또한, total bilirubin (TBIL) (mg·dL-1) 수치에서도 생균제(T2) 처리구가 다른 처리구에 비해 유의미하게 높은 값을 보였다(p < 0.01). 이는 미세조류 첨가가 자돈의 간 기능에 추가적인 영향을 미칠 수 있다는 점을 나타내며, 본 결과는 더 심도 있는 연구를 통해 그 원인을 명확히 규명할 필요가 있다.
해당 연구에서 관찰된 높은 ALT 및 TBIL 수치의 원인은 사료 성분, 실험 환경, 또는 돼지의 초기 건강 상태 등 다양한 요인에 의해 발생할 수 있으며, 이와 관련된 추가적인 연구가 필요할 것으로 보인다.
Table 3.
Effect of dietary immunomodulatory substances on the serum biochemistry of weanling piglets.
| Item | Treatmentz | SEM | p-value | |||
| CON | T1 | T2 | T3 | |||
| GLU (mg·dL-1) | 123.60 | 110.33 | 110.20 | 113.73 | 5.47 | 0.274 |
| CREA (mg·dL-1) | 0.83 | 0.80 | 0.91 | 0.77 | 0.03 | 0.083 |
| BUN (mg·dL-1) | 5.53 | 7.33 | 7.93 | 5.27 | 0.88 | 0.092 |
| BUN/CREA | 7.07 | 9.33 | 6.00 | 7.00 | 0.89 | 0.097 |
| PHOS (mg·dL-1) | 8.31 | 8.29 | 8.65 | 8.75 | 0.27 | 0.516 |
| CA (mg·dL-1) | 9.59 | 9.33 | 9.11 | 9.35 | 0.17 | 0.296 |
| TP (g·dL-1) | 4.89 | 4.85 | 4.96 | 4.99 | 0.12 | 0.819 |
| ALB (g·dL-1) | 2.22 | 2.21 | 2.29 | 2.41 | 0.08 | 0.261 |
| GLOB (g·dL-1) | 2.69 | 2.64 | 2.67 | 2.59 | 0.06 | 0.692 |
| ALB/GLOB | 0.82b | 0.85ab | 0.86ab | 0.94a | 0.03 | 0.047 |
| ALT (U·L-1) | 241.00ab | 305.47a | 260.40ab | 226.33b | 18.17 | 0.019 |
| ALKP (U·L-1) | 287.60 | 317.87 | 307.93 | 315.60 | 20.38 | 0.714 |
| GGT (U·L-1) | 26.53 | 29.93 | 26.40 | 22.47 | 2.67 | 0.282 |
| TBIL (mg·dL-1) | 0.11b | 0.12b | 0.31a | 0.17ab | 0.04 | 0.007 |
| CHOL (mg·dL-1) | 101.73 | 93.87 | 103.80 | 98.00 | 3.54 | 0.219 |
| AMYL (U·L-1) | 534.87 | 583.33 | 583.67 | 572.13 | 59.00 | 0.928 |
| LIPA (U·L-1) | 87.40 | 40.60 | 62.53 | 86.93 | 17.27 | 0.181 |
GLU, glucose; CREA, creatinine; BUN, blood urea nitrogen; PHOS, phosphorus; CA, calcium; TP, total protein; ALB, albumin; GLOB, globlin; ALT, alanine aminotransferase; ALKP, alkaline phosphatase; GGT, gamma glutamyl transpeptidase; TBIL, total billirubin; CHOL, cholesterol; AMYL, amylase; LIPA, lipase.
혈구세포를 분석한 결과는 Table 4와 같다. 모든 처리구에서 참고 문헌(Zhang et al., 2022)에서 나타낸 정상 수준에서 유의적 차이를 나타내지 않았다(p > 0.05). 면역조절물질은 가축의 건강 및 기초대사생리에 유해한 영향을 주지 않는 것으로 확인되었으나, 미세조류 및 생균제 첨가 그룹에서 다른 그룹에서 보다 white blood cells (WBC) 수치가 증가하는 것이 확인되었다. 이는, 미세조류 및 생균제 첨가가 자돈의 백혈구 수치를 증가시켜 자돈의 면역 발달에 영향을 미쳤을 가능성을 나타낸다.
Table 4.
Effect of dietary immunomodulatory substances on the blood cells of weanling piglets.
| Item | Treatmentz | SEM | p-value | |||
| CON | T1 | T2 | T3 | |||
| RBC (M·µL-1) | 6.14 | 6.57 | 6.79 | 6.70 | 0.18 | 0.074 |
| HCT | 33.40 | 35.69 | 36.95 | 37.16 | 1.09 | 0.067 |
| HGB | 9.71 | 10.33 | 10.53 | 10.60 | 0.30 | 0.150 |
| MCV | 54.06 | 54.45 | 54.59 | 55.59 | 0.95 | 0.705 |
| MCH | 15.81 | 15.77 | 15.53 | 15.85 | 0.23 | 0.766 |
| MCHC | 29.25 | 29.00 | 28.53 | 28.54 | 0.34 | 0.360 |
| RDW | 24.05 | 24.09 | 24.30 | 24.13 | 0.49 | 0.985 |
| %RETIC | 1.69 | 1.25 | 1.81 | 1.61 | 0.23 | 0.360 |
| RETIC | 107.99 | 81.48 | 122.13 | 105.82 | 15.22 | 0.308 |
| WBC | 21.90 | 23.81 | 24.65 | 21.96 | 1.84 | 0.646 |
| NEU (%) | 34.89 | 34.51 | 34.85 | 36.41 | 2.10 | 0.921 |
| LYM (%) | 58.64 | 59.53 | 59.08 | 57.86 | 2.01 | 0.945 |
| MONO (%) | 5.39 | 4.84 | 5.09 | 4.69 | 0.44 | 0.695 |
| EOS (%) | 1.02 | 1.08 | 0.95 | 0.98 | 0.15 | 0.934 |
| BASO (%) | 0.06 | 0.04 | 0.03 | 0.05 | 0.02 | 0.746 |
| NEU | 7.70 | 8.36 | 9.12 | 8.01 | 1.12 | 0.827 |
| LYM | 12.79 | 14.04 | 14.07 | 12.65 | 0.95 | 0.581 |
| MONO | 1.17 | 1.16 | 1.25 | 1.07 | 0.14 | 0.823 |
| EOS | 0.23 | 0.25 | 0.21 | 0.22 | 0.03 | 0.841 |
| BASO | 0.01 | 0.01 | 0.01 | 0.01 | 0.00 | 0.852 |
| PLT | 634.67 | 692.60 | 652.67 | 598.20 | 51.94 | 0.636 |
| MPV | 9.37 | 9.09 | 9.25 | 9.57 | 0.20 | 0.462 |
| PDW | 13.07 | 12.05 | 12.14 | 12.85 | 0.51 | 0.476 |
| PCT | 0.65 | 0.62 | 0.63 | 0.59 | 0.05 | 0.892 |
RBC, red blood cell; HCT, hematocrit; HGB, hemoglobin; MCV, mean cell volume; MCH, mean corpuscular hemoglobin; MCHC, mean corpuscular hemoglobin concentration; RDW, red blood cell distribution width; %RETIC, %reticulocyte; RETIC, reticulocyte; WBC, white blood cell; NEU; neutrophil; LYM, lymphocyte; MONO, monocyte; EOS, eosinophil; BASO, basophil; PLT, platelet; MPV, mean platelet volume; PDW, platelet distribution width; PCT, plateletcrit.
면역조절물질 첨가에 따른 자돈 장관면역 변화 분석
자돈 장관 구조 및 형태 분석
실험에 사용된 면역조절물질의 급여가 자돈의 장건강에 미치는 영향을 평가하기 위하여 자돈에서 면역조절물질을 첨가 급여 후 공장 조직의 융모 높이, 음와 깊이, 그리고 융모 높이 대비 음와 깊이의 비율을 분석하였다. 하지만 해당 면역조절물질 급여는 자돈의 공장조직 발달 등에는 유의적 차이를 나타내지 않았다(Table 5).
선행연구에서 자돈을 대상으로 Lipopolysaccharide (LPS)를 처리에 따른 면역 자극을 유도한 후 Clostridium butyricum 및 Enterococcus faecalis를 사료 내 첨가하여 공장 조직의 형태학적 영향을 확인하였다. 본 연구 결과와는 다르게 선행연구에서 공장 융모의 높이와 선와 깊이의 비율이 유의하게 증가함을 보고하였다(Wang et al., 2019a). 이는, 자돈 사료 내 미세조류 첨가가 면역 자극이 유도된 상태에서 효과가 있음을 확인할 수 있으며, 추가적으로 면역 반응 유도를 통해 면역조절물질 첨가 효과를 구명하는 연구가 필요할 것으로 보인다.
Table 5.
Effect of immunemodulatory substances supplementation on the intestinal structure and health of piglets.
| Item (µm) | Treatmentz | SEM | p-value | |||
| CON | T1 | T2 | T3 | |||
| VH | 412.35 | 402.69 | 457.73 | 406.71 | 22.25 | 0.296 |
| CD | 217.71 | 236.73 | 221.71 | 249.77 | 12.71 | 0.291 |
| VH : CD | 1.97 | 1.74 | 2.10 | 1.68 | 0.12 | 0.078 |
자돈 사이토카인 변화
자돈은 출생 시 면역학적으로 매우 취약한 상태이다. 출생 직후 자돈의 장 상피세포와 고유판(lamina propria)에는 림프구와 면역세포의 발달이 미비하며, 생후 2주 내에 장 내 T 림프구가 출현하지만, 이 시기의 림프구는 CD4 또는 CD8 표면 마커를 발현하지 않는다. 약 5주령에 이르러 장 상피세포에 CD8+ T세포가 군집화되기 시작하고, 7주령에 이르러야 성숙한 돼지의 장관 구조와 유사한 형태로 발달한다(Stokes, 2017). 따라서, 면역 발달이 느린 자돈의 면역을 효과적으로 향상시키기 위해 면역 강화 전략이 필요하다. 이에 따라, 자돈의 사료 내 면역조절물질 첨가에 따른 자돈 혈청 내 사이토카인 변화를 확인하였다.
혈청 사이토카인을 측정한 결과, 염증 반응과 세포 사멸에 관여하는 TNF-α는 처리구 간에 유의미한 차이가 없었으나(p > 0.05), T세포의 발달과 natural killer (NK) 세포의 활성을 돕는 IL-2 수치는 대조구에 비해 탱자껍질 추출물을 처리한 그룹에서 유의미하게 증가하였다(p < 0.05) (Table 6). IL-2는 염증 반응을 촉진하는 pro-inflammatory cytokine으로, 이러한 수치 증가는 탱자껍질 추출물의 활성 성분이 자돈의 미성숙한 면역 시스템에서 T세포 성장과 분화를 촉진하고 NK세포 활성을 강화했음을 시사한다. 또한, 항염증 사이토카인으로 잘 알려진 IL-10 수치도 대조군에 비해 탱자껍질 추출물을 처리한 그룹에서 유의미하게 증가하였다(p < 0.05). IL-10은 염증 반응을 억제하고 면역계의 균형을 유지하는 역할을 한다. IL-10 수치 증가는 탱자껍질 추출물이 자돈의 염증 반응을 억제하고 면역 균형을 유지하는 데 긍정적인 영향을 미쳤음을 나타낸다. 따라서 탱자껍질 추출물을 첨가한 자돈 사료가 IL-2와 IL-10 수치를 유의미하게 증가시킨 결과는 자돈의 면역 발달 과정에서 중요한 역할을 했을 가능성을 보여준다.
면역적으로 미성숙한 자돈의 면역 발달을 촉진하고, 염증 반응을 조절하여 자돈의 건강 증진에 기여할 수 있는 잠재적인 기능성 사료 첨가제로서의 가능성을 제시한다.
Table 6.
Effect of dietary immunomodulatory substances on cytokine of weanling piglets.
| Item (µm) | Treatmentz | SEM | p-value | |||
| CON | T1 | T2 | T3 | |||
| TNF-α | 111.83 | 93.67 | 91.68 | 89.61 | 4.97 | 0.376 |
| IL-2 | 14.20b | 14.55b | 15.36b | 21.02a | 0.73 | < 0.001 |
| IL-10 | 7.02b | 11.88ab | 9.86ab | 14.44a | 0.93 | 0.028 |
자돈 장내 미생물 변화 분석
출생 직후 자돈의 장내 미생물은 주로 Firmicutes가 지배적이며 이유자돈의 장내 미생물은 Clostridium, Roseburia, Prevotella 등이 주로 우점하게 된다(Bian et al., 2016).
자돈의 장내 미생물의 다양성은 출생 후 점진적으로 증가하며, 장내 미생물의 다양성 증가는 자돈의 건강과 성장에 중요한 역할을 가지므로 초기 자돈의 영양 조절 전략을 통해 자돈의 강건성을 증진 시킬 수 있다.
이유자돈을 대상으로 사료 내 면역조절물질(미세조류, 생균제, 탱자껍질 추출물) 첨가에 따른 장내 미생물 군집에 대한 풍부도 및 다양성에 미치는 영향을 조사하기 위해 operational taxonomic units (OTUs), Shannon, Evenness 분석을 적용하여 α-diversity 분석을 실시하였다(Table 7). 분석 결과 탱자껍질추출물 처리구의 OTUs가 대조구에 비해 증가하는 경향을 나타냈지만 모든 분석항목에서 통계적으로 유의한 차이는 보이지 않았다. 이러한 결과는 면역조절물질 첨가 급여가 장내 미생물 다양성에는 영향을 미치지 않는다는 것을 나타낸다.
Table 7.
Number of sequences, operational taxonomic units (OTUs), and diversity estimates of bacteria in feces.
| Index | Treatmentz | SEM | p-value | |||
| CON | T1 | T2 | T3 | |||
| OTUs | 406.07 | 425.27 | 439.33 | 475.60 | 17.83 | 0.053 |
| Shannon | 6.88 | 6.82 | 6.85 | 6.91 | 0.10 | 0.940 |
| Evenness | 0.80 | 0.78 | 0.78 | 0.78 | 0.01 | 0.464 |
또한, 대조구 그룹과 면역조절물질 첨가 그룹 간의 장내 미생물 군집의 차이를 분석하기 위해 β-diversity 분석을 실시하였다(Fig. 1). β-diversity 측정값은 주성분 분석(principal coordinates analysis, PCoA plot)으로 제시되며 그룹은 면역조절물질 첨가에 따른 세 가지 구성요소(PC : PC1-14.01%, PC : PC2-7.35%, PC : PC3-3.707%)로 나뉘었다. β-diversity 분석 결과, 면역조절물질 첨가에 따른 자돈 분변 미생물 균총이 일부 변화함을 확인을 할 수 있으며, 면역조절물질 첨가가 자돈의 장내 미생물 균총에 일부 영향을 주는 것으로 추측할 수 있다.
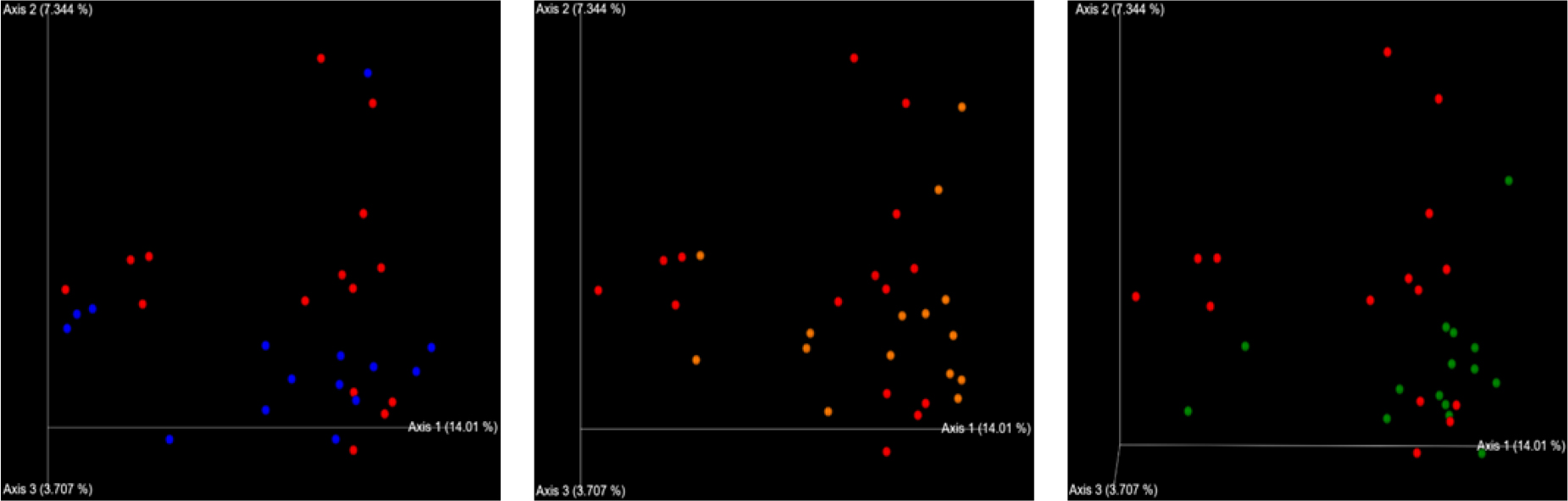
Fig. 1.
Principal coordinates analysis (PCoA) plots based on weighted UniFrac distance metrics Individual samples for treatments are designated with the following symbols. CON (red), T1 (blue), T2 (orange), and T3 (green). CON (control), basal diet; T1, CON + microalgae (Parachlorella spp. 0.5%); T2, CON + probioctics (Lactobacillus paracasei subsp. tolerans 0.1%); T3, CON + agricultural by-products (trifoliate orange peel extract 0.2%); SEM, standard error of the mean.
다음은 면역조절물질 첨가에 따른 자돈 분변 내 미생물 균총 조성 차이를 분석하였다. 자돈 분변 내 장내 미생물 분류학적 균총 분포 분석 결과, 대조군 및 처리군에서 phylum (문) 수준에서 Firmicutus (대조군, 61%; T1, 61%; T2, 64%; T3, 64%) Bacteroidetes (대조군, 31%; T1, 29%; T2, 28%; T3, 27%) 순으로 나타났으며(Fig. 2A), 자돈 분변 미생물 군집을 분석한 선행연구 결과와 일치하였다(Yang et al., 2021).
Genus (속) 단계에서 자돈 분변 내 미생물 균총 조성 차이를 분석한 결과(Fig. 2B), Clostridium sensu stricto 1 (대조군, 21%; T1, 21%; T2, 22%; T3, 28%) 계열의 균주가 대조구 및 모든 처리구에서 우점종으로 확일할 수 있으며, 모든 처리군에서 genus (속) 수준에서 Prevotella 7 계열의 균주가 감소하는 경향을 나타내었다. 대조군 대비 처리군의 Prevotella 감소 비율은 미세조류(T1) 처리에서 28% 감소, 생균제(T2) 처리에서 71% 감소, 탱자껍질 추출물(T3)에서 56% 감소를 보였다. Prevotella 계열이 지배적인 장내 미생물 군집을 가진 자돈은 만성 염증성 질환에 취약할 수 있다는 보고가 있다(Yang et al., 2019).
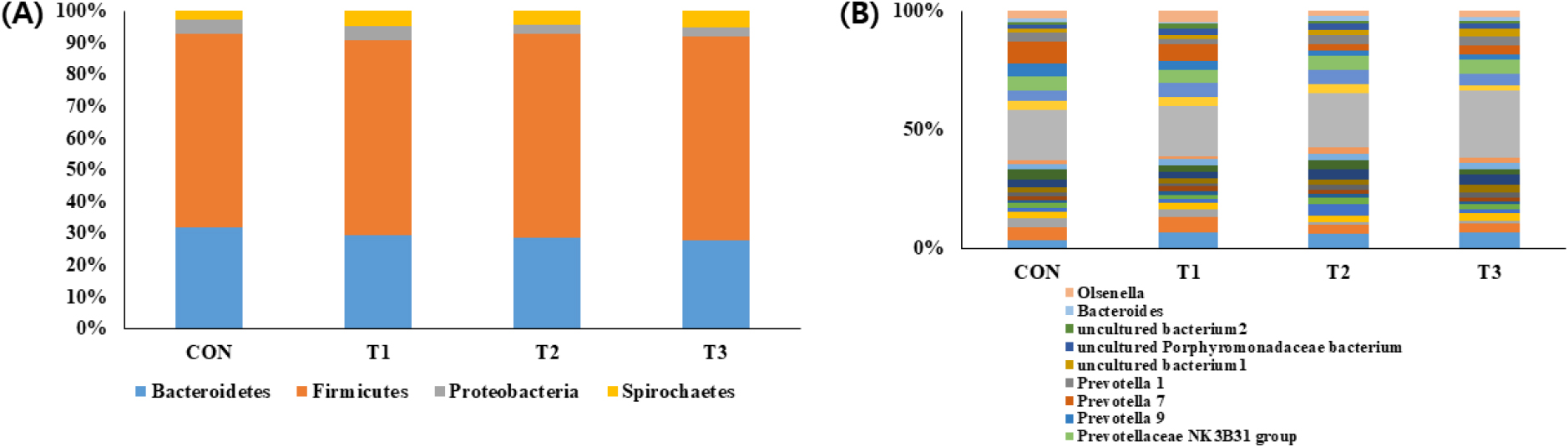
Fig. 2.
Microbial taxonomic profiles from the feces of the four dietary treatments at the phylum and genus levels. The taxonomic composition of the feces among the treatment groups was compared based on the relative abundance (A, Phylum, B: Genus). CON (control), basal diet; T1, CON + microalgae (Parachlorella spp. 0.5%); T2, CON + probioctics (Lactobacillus paracasei subsp. tolerans 0.1%); T3, CON + agricultural by-products (trifoliate orange peel extract 0.2%); SEM, standard error of the mean.
Prevotella 계열의 증가는 돼지 장내 점액층을 얇게 하여 장 상피세포 내 국소 염증을 일으키는 병원균의 침입에 더 취약하게 만들 수 있다는 결과가 있다(Rodríguez-Piñeiro and Johansson, 2015). 자돈을 대상으로 면역조절물질 첨가가 자돈의 면역적 항상성 유지 및 장내 물리적 장벽 장내 점액층 증가를 통해 자돈의 전반적인 장 건강 향상에 도움을 줄 가능성이 있음을 나타낸다.
자돈 사료에 면역조절물질 첨가에 따른 자돈 분변 내 미생물 분포에 대한 유의적 차이를 보이는 균주를 분석하기 위해 LEfSe 분석을 실시하였다(Fig. 3). Unclassified 균주는 제외하고, LDA score > 2, p < 0.05에 해당하는 OTUs를 선별하여 분석한 결과, 면역조절물질 첨가 급여 시 특정 미생물 균총이 증가하는 것을 관찰하였다.
사료 내 미세조류(T1)를 첨가한 결과 genus (속) 수준에서 Oxalobacter 계열의 균주가 풍부해지는 결과를 보였다. 선행연구에 따르면 calcium oxalate의 발생은 단핵구의 염증성 M1 대식세포 분화를 증가시켜 염증성 사이토카인의 분비 증가를 유발한다. 하지만, genus (속) 수준의 Oxalobacter 계열의 증가는 장내 oxalate를 에너지로 사용함에 따라 염증 유도 물질 calcium oxalate 발생 감소 결과가 보고되었다(Baltazar et al., 2023). 이는, 자돈의 장내 과도한 염증 반응을 억제함으로써 자돈 장내 면역체계 균형 유지에 도움을 줄 수 있다(Fig. 3A).
다음으로 사료 내 생균제(T2) 첨가에 따른 자돈의 장내 미생물 조절 효과를 확인하였다. 선행연구 결과에 따르면 생균제(T2) 첨가 시 Streptococcaceae family (과)에 속하는 Streptococcus 계열 증가를 보인 연구 결과가 있으며(Buriti et al., 2007) 이는, 본 연구와 유사한 경향을 보였다(Fig. 3B). 또한 Streptococcus의 증가는 병원균의 증식을 억제하며 항염증성 사이토카인(anti-inflammatory cytokine) IL-10의 분비를 증가시켜 염증을 억제하며 면역 균형 유지에 영향을 줄 수 있음을 알 수 있다(Zeng et al., 2021).
자돈 사료 내 탱자껍질 추출물(T3) 첨가에 따른 자돈의 장내 미생물 조절 효과를 확인하였다. 탱자껍질 추출물 첨가에 따라 특정 미생물 균총이 증가하는 것을 확인하였으며(Fig. 3C) 특히 class (강) 수준의 Clostridia 계열이 증가하는 것을 확인하였다. Clostridia 계열의 균주 증가는 항 염증성 사이토카인 IL-10, TGF-β 상승 및 염증성 사이토카인 TNF-α, IL-1β 감소를 유도하는 효과를 가지고 있다(Chen et al., 2018). 또한, Clostridia 계열의 증가는 장내 면역글로빈 IgA, IgG의 생산을 유도하여(Wang et al., 2019b), 장관 점막을 강화하여 장내 병원균 침입을 제어하는 효과를 나타낼 수 있음을 시사한다.
면역조절 후보물질 급여에 따른 장내미생물 변화 분석 연구에서 흥미롭게도 공통적으로 면역조절물질 첨가 시 Oxalobacter 계열의 증가를 확인할 수 있었으며(Fig. 3) 이는, 면역조절물질(T1, T2, T3)이 장관면역 항상성 유지에 긍정적인 영향을 미칠 가능성을 나타낸다.
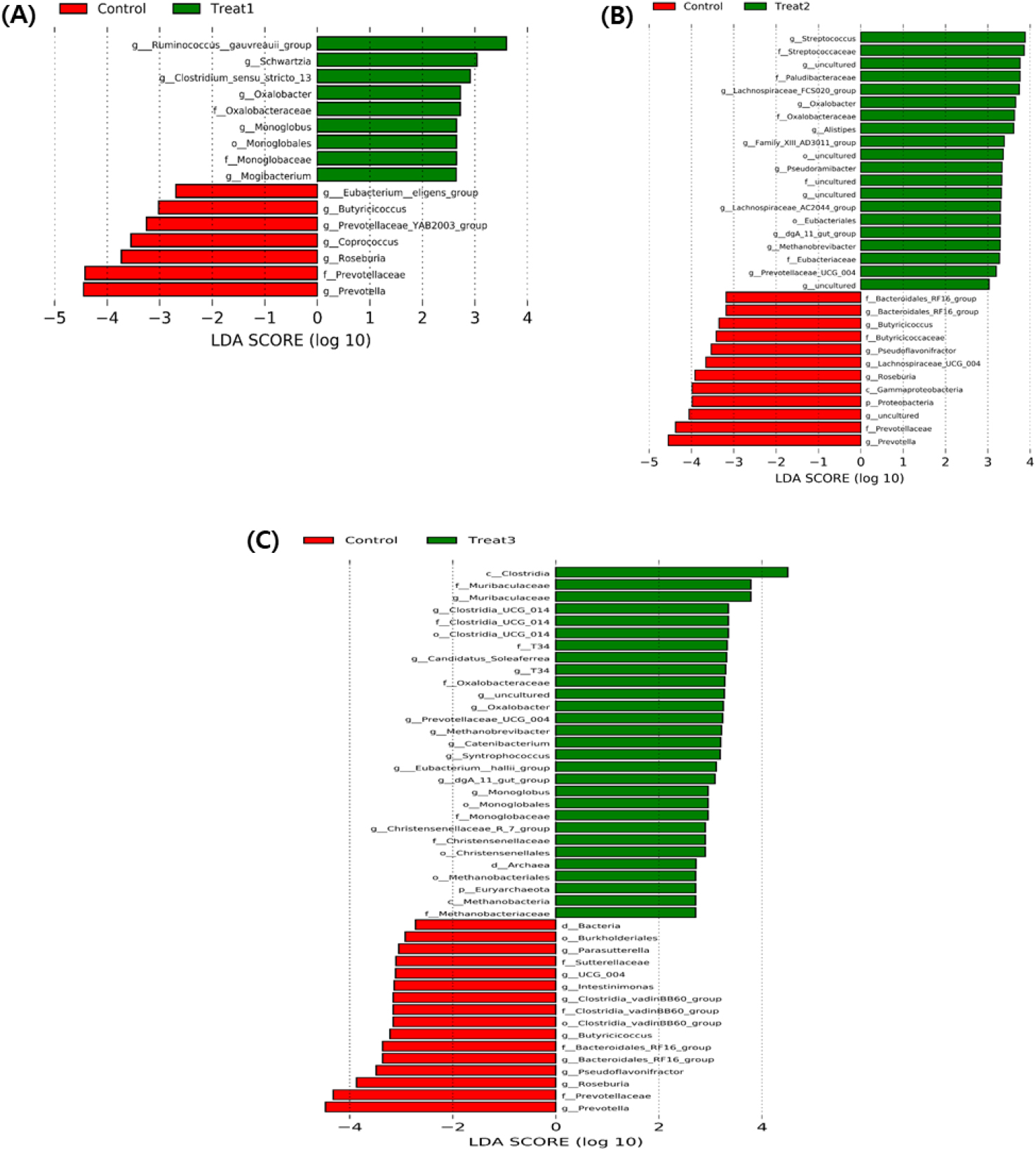
Fig. 3.
Linear discriminant analysis (LDA) and linear discriminant analysis effect size (LEfSe) were performed on the microbial community relative abundance data from the feces of piglets. CON (control), basal diet; T1, CON + microalgae (Parachlorella spp. 0.5%); T2, CON + probioctics (Lactobacillus paracasei subsp. tolerans 0.1%); T3, CON + agricultural by-products (trifoliate orange peel extract 0.2%); SEM, standard error of the mean.
Conclusion
본 연구에서 생후 28일령 자돈을 대상으로 사료 내 미세조류, 생균제, 탱자껍질 추출물 첨가가 자돈의 면역 체계 및 장내 미생물에 미치는 영향을 조사하였다. 연구 결과, 탱자껍질 추출물의 첨가가 자돈의 면역 발달을 촉진하고 면역적 항상성을 유지하는 데 긍정적인 영향을 미친다는 것을 확인하였다. 특히, 항염증성 사이토카인 IL-10과 염증성 사이토카인 IL-2의 유의미한 증가가 나타나 자돈의 면역 반응 강화와 염증 조절에 효과적임을 시사하였다. 또한, 사료 내 면역조절물질(미세조류, 생균제, 탱자껍질 추출물)의 첨가는 Oxalobacter 계열의 유익균을 풍부하게 하여 장내 미생물 균형을 개선하고, 옥살산 대사 및 산화 스트레스 억제와 같은 항산화 효과를 통해 자돈의 장관 면역력을 강화하는 데 기여하였다. 따라서 본 연구는 자돈 사료 내 면역조절물질 첨가가 자돈의 면역 체계를 강화하고, 장내 환경을 개선하여 가축의 강건성을 향상시키는 효과적인 방법임을 확인하였다. 이는 면역조절물질을 활용한 사료첨가제 개발에 있어 중요한 기초 자료를 제공하며, 향후 가축 사육 현장에서의 적용 가능성을 높이는 데 기여할 수 있을 것으로 판단된다.




